Обеспечение экологической безопасности путем разработки малоотходного способа реутилизации сернокислых отходов аккумуляторных батарей
Дополнительным фактором, препятствующим выделению металлов на катоде, является наличие примесей железа. При содержании железа более 20 мг/л выход по току выделяемого металла резко падает. Негативное влияние железа объясняется тем, что на катоде одновременно выделяются и извлекаемый металл, и железо, у которого перенапряжение выделения водорода ниже, чем у других металлов.
Входящие в состав аккумуляторного электролита ионы железа и марганца, расположенные в ряду напряжений левее водорода, способны вытеснять его из кислот [3]. Описанный процесс будет препятствовать выделению железа и марганца на катоде в сернокислом аккумуляторном электролите, концентрации ионов водорода в котором выше концентрации ионов металлов в 3000 раз. По литературным данным, выделение железа на катоде начинается с момента, когда концентрация серной кислоты снижается до 15 г/л [4]. Марганец является одним из наиболее электроотрицательных металлов, его стандартный потенциал Ф°мп/мп" = -1,18 В. Поэтому выделить марганец на катоде в кислой среде не удается.
Однако электролитическое железо может представлять интерес только в двух случаях: при получении очень чистого железа или железного порошка. Для решения поставленной в работе задачи реутилизации аккумуляторного электролита представляет интерес тот факт, что ионы Fe3+ в аккумуляторе попадают к отрицательному электроду и восстанавливаются свинцом, т.е. вызывают саморазряд отрицательного электрода. Если же эти ионы будут находиться в электролите в двухвалентном состоянии, то они не будут оказывать отрицательного влияния на эксплуатационные характеристики аккумуляторной кислоты.
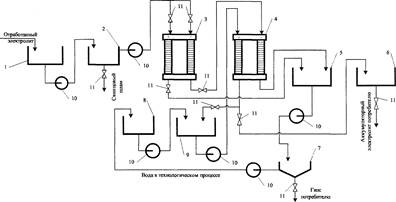
Согласно рассмотренным закономерностям можно утверждать, что при регенерации растворов отработанного аккумуляторного электролита, в которых концентрация ионов водорода значительно превышает концентрацию ионов металлов (СМе~ " Си*), металлы на катоде выделяться не будут. Второе направление — перенос катионов Fe3+, Cu2+, Мп2+ через катионитовую ионообменную мембрану из анодной области в катодную. В результате концентрирования ионов металлов в катодной области в анодной области можно получить очищенный раствор серной кислоты, не содержащий примесей металлов. При этом ионы С1" окисляются на аноде до С12 и выделяются в виде газа [5]. На результат данного процесса влияют катодная плотность тока и время проведения процесса с катионов Fe3+, Cu2+, Мп2+ через катионитовую ионообменную мембрану из анодной области в катодную.
В результате концентрирования ионов металлов в катодной области в анодной области можно получить очищенный раствор серной кислоты, не содержащий примесей металлов. При этом ионы С1" окисляются на аноде до С12 и выделяются в виде газа [5]. На результат данного процесса влияют катодная плотность тока и время проведения процесса. Согласно теоретическим исследованиям на результат процесса извлечения примесных металлов из отработанного раствора электролита влияют следующие факторы:
в катодная плотность тока;
• концентрация ионов водорода (кислотность среды);
• начальная концентрация ионов серной кислоты и примесных металлов;
в время проведения процесса.
Схема II реутилизации аккумуляторного электролита предполагает извлечение серной кислоты из отработанного сернокислого раствора [4]. Выделение серной кислоты из регенерата может быть достигнуто в двухкамерной ячейке со свинцовым анодом и анионитовой мембраной. Извлечение сернокислого марганца из раствора серной кислоты может быть осуществлено в двухкамерном электродиализаторе, разделенном анионо-обменной мембраной. Регулируя силу тока и подачу исходного раствора в катодную камеру, можно добиться такой работы системы, что из анодной камеры будет выходить чистая серная кислота, а из катодной — сернокислый марганец. Под действием тока сульфат-ионы переходят из католита в анолит. На аноде происходит разложение воды по реакции Н20 - 2ё -> 1/202 + 2Н+, причем выделяется газообразный кислород, а ионы водорода остаются в растворе и образуют с сульфат ионами раствор серной кислоты. Загрязняющие электролит примеси металлов (железо, медь, марганец, хлориды, свинец) концентрируются в катодной области.
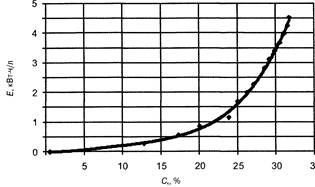
При исследовании процесса регенерации серной „ кислоты в качестве выходных параметров следует рассматривать конечную концентрацию кислоты в камере концентрирования и энергетические затраты.
Количественными факторами, определяющими процесс извлечения серной кислоты из отработанного электролита свинцово-кислотных аккукмуля-торов, являются:
S катодная плотность тока;
s время протекания процесса;
s степень воздействия процесса регенерации на окружающую среду.
Другие статьи по экологии
Технологическая схема механической очистки промливневых стоков
Промливневые
стоки с ТСБ поступают самотеком по канализационным сетям на узел сбора и
откачки стоков ТСБ и из приёмного резервуара тит.250/105 и насосами насосной
тит. 250/104 по напорному коллекто ...
Питьевая вода деревни Уть
Мы начинаем нашу жизнь в виде плода, который состоит из
воды на 99 %. Когда мы рождаемся, вода составляет 90
% нашего тела, а к тому времени, когда мы достигаем взрослого возраста,
содержан ...
Геоинформационные системы в охране окружающей среды
Во всем мире проблемам
охраны окружающей среды сейчас уделяется повышенное внимание. И это не
удивительно. Бурное развитие хозяйственной деятельности людей создало все
предпосылки реальной ...